
實驗動物非常規眼科檢查簡介
如前文《實(shí)驗動物的常規眼科檢查》一文中所寫,眼(yǎn)科檢查的操作(zuò)流程可因動物(wù)種屬和特點(diǎn)的研究目的而異。如果目的是篩查藥物等(děng)物質對(duì)眼部組織的不良影響(xiǎng),則應至少進行間接檢眼(yǎn)鏡和(hé)裂(liè)隙燈顯微鏡的檢查。根據檢查目的,也可執行其(qí)它程序,比如角膜染(rǎn)色(sè)、角膜(mó)知(zhī)覺檢(jiǎn)查(chá)、角膜厚度測量、眼(yǎn)壓計、眼底照相、熒光血管造影、光學相幹斷層掃(sǎo)描 (OCT, Optical Coherence Tomography) 和視覺係統(tǒng)的電生理評估(例如視網膜電圖、多焦視網膜電圖、視覺誘發電位)。
許多無創性眼(yǎn)科診斷技術,可同時提供眼前節與眼(yǎn)後節的結(jié)構和功能信息。下(xià)麵討論了其中一些技術,對這些(xiē)技術適用於毒理學、眼科研究(jiū)和臨床應用的場景進行了初步討論(lùn)。
01、眼壓測量
眼壓計用於獲得眼內壓 (IOP, Intraocular Pressure) 的間接測(cè)量值。市(shì)麵(miàn)上有幾(jǐ)種(zhǒng)不同的(de)商品化的手持式設備,其便攜性足以(yǐ)供眼科檢查(chá)人員使用,如壓陷、壓平或回彈式眼壓計。對於合同研發組織(CROs, Contract research organizations)使用的多種動物(wù)種屬,通常認為Schiotz壓(yā)陷式眼壓計的結果(guǒ)不準確、不可靠,因此不應用於眼部毒理學研究。由於許多眼壓計最初(chū)設計用(yòng)於人的(de)角膜(mó),用於動物的讀數可(kě)能略不準確,但如果在整個研究期間由同(tóng)一(yī)名檢查者(zhě)使用相同(tóng)的眼壓計,則研究中(zhōng)發生的眼壓變化將是有效的。
大多數實驗動物的 IOP 範圍(wéi)為 12-25 mmHg,雙眼之間的差異應≤5 mmHg。IOP 可受到多(duō)個變量的影響,如:保定技術、動物應激、晝夜節(jiē)律眼位、鎮靜或麻醉、角膜厚度等。如果可能,在進行眼壓測量時,應在整個研究(jiū)期間保(bǎo)持如下細節的統一:每天相同的測量時間、相同的(de)眼壓計和操作技術、同一組檢查人員和保定人員,來測量試驗內所有動物的 IOP。應在散瞳之前(qián)測定眼壓。當眼壓測量(liàng)是(shì)研究的關鍵點時,建議研究開始前先對動物進(jìn)行保定適應和操作適應(yīng)。
最常使用的是壓平式(shì)眼壓計,如Tono-Pen XL®、Tono-Pen Vet®、Tono-Pen AVIA® ,或非接觸式眼壓計。眼壓測量需表麵麻醉時,0.5% 丙美卡因是最常見的選擇。該技術測量壓平角(jiǎo)膜給定區域所(suǒ)需的(de)力,然後(hòu)將該施加力轉換(huàn)為眼壓值(單位(wèi):mmHg)。一(yī)些壓平式眼壓計具有(yǒu)自我校準的優勢(圖(tú)1),而非接觸式眼壓計可提供紙(zhǐ)質副本用於記(jì)錄保存,兩者都是藥物非臨床研究質量管理規範(fàn)(GLP,Good Laboratory Practice)類研究的理想技術。Tono-Pen XL 和 Tono-Pen Vet® 產生4個(gè)獨立讀數,可對讀(dú)數取(qǔ)平均值,並顯示(shì)IOP和誤差百分比,即單個讀(dú)數之間變異性。Tono-Pen AVIA® 產生10 個獨立讀數,並以置信度百分比報告 IOP 和變異性。對於(yú) Tono-Pen XL®,誤差百分比應 <5%,而對於 Tono-Pen AVIA®,置信度百分比應 >95%。
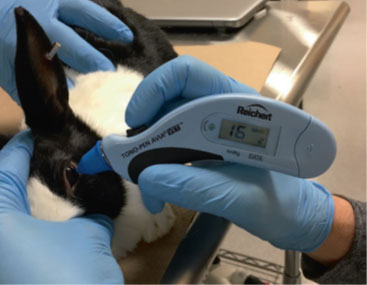
圖1 Tono-Pen AVIA Vet® 用於測量Dutch Belted Rabbit的眼壓
回彈式眼壓計通過向角膜發射一個小的塑料探(tàn)針頭來確定眼壓,然後探頭反彈回設備中,產生感應電流(liú),由此計算眼壓值。為了準(zhǔn)確測量,探針必須(xū)以水平位置在角膜上擊發,即探針與地(dì)板平行。實驗動物最(zuì)常用的回彈眼壓計是(shì) Tonovet®(圖2a)。Tonovet® 專門針對犬、貓和馬進行(háng)了校準,但也已在其它種屬中可靠地使用。TonoLab 眼壓計是專門為小鼠和大鼠設(shè)計和校準的(圖2b)。在許多實驗動物中,包括犬、兔和大鼠,Tonovet 和 TonoLab 眼壓計具有不需要局部麻醉的優點,並且比 Tono-Pen® 更容易獲得 IOP,其缺(quē)點是在使用前不能自行(háng)校準(zhǔn)。與 Tono-Pen® 和 Tonovet® 一樣,它也取6 個讀數的平均值,並使用眼壓值的左側欄指示誤差百分比。測量時,應沒有錯誤(wù)欄,或者(zhě)欄應該位於屏幕的左下角,以使讀數可以接受。
無論使用何種眼壓計(jì),通常每隻眼應獲得並記錄至少 2-3 個最終平均讀(dú)數。由於除非接觸式外(wài)的所有眼壓計僅給出數字讀數,設備不會創建永久性記錄,因此必須手動記錄 IOP 或將其輸入計算機數(shù)據庫中(zhōng)。
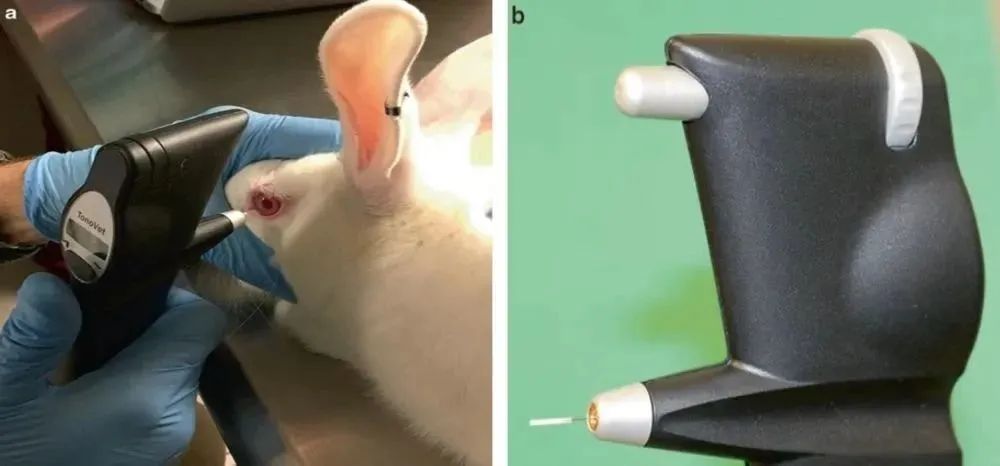
圖2 (a) The Tonovet® 回(huí)彈式眼壓計測量New Zealand white rabbit眼壓 (b) TonoLab 眼壓計小小(xiǎo)的尖端可用於齧齒類(lèi)的(de)眼壓測定(dìng)
02、角膜厚度測量法
角膜厚度測量法是一種無創(chuàng)性(xìng)評價角膜厚度(dù)的方法。 最常使用專門為此目的設(shè)計的接(jiē)觸式超聲設備(例如 PachPen®)進行(圖3),但也可以通過高分(fèn)辨率超聲檢查或(huò)光學(xué)相幹斷層(céng)掃描(OCT, Optical Coherence Tomography)獲(huò)得角膜厚度的測(cè)量結果。在角膜水(shuǐ)腫可被生物顯(xiǎn)微鏡(jìng)檢測出之前,角膜厚度測量法可對角膜厚(hòu)度的細微變化進行評價。角膜厚度可因種(zhǒng)屬的不同,以及角膜區域不(bú)同(tóng)(軸向或周邊)而變化。由於區(qū)域差異(yì),必須(xū)在每個時間(jiān)點從角膜的(de)相同(tóng)區域進行測量,通常選用軸向。
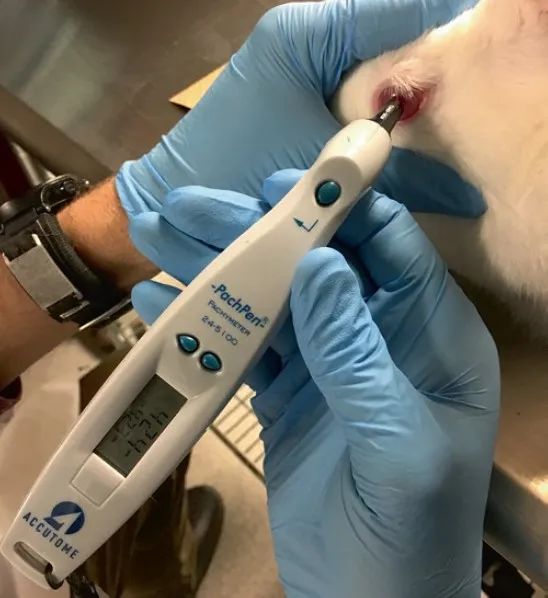
圖3 PachPen 測量New Zealand white rabbit角膜厚度
03、熒光素染色法
在涉及眼局(jú)部給藥、角膜接觸鏡評價的研究,和(hé)使用改良 Hackett-McDonald 評分係統(tǒng)的(de)其(qí)他研究(jiū)中,通常使用熒光素鈉溶液評(píng)價角膜上(shàng)皮的完整性。熒光素(sù)是一種水溶性熒光染料,可被親水性角膜基質保留,但不被角膜上皮保留。它可(kě)用於輔助識別角膜(mó)上皮(pí)缺損,也可用於評價(jià)角膜前的淚膜滯留。熒光素以單個浸漬(zì)條帶(dài)的形式提供,使用時使用無(wú)菌生理鹽水潤濕(shī)。將濕潤的條帶(dài)輕輕塗抹在背(bèi)側球結膜上,注意不要接觸角膜。然後使用鹽水輕輕衝洗多餘的熒光(guāng)素(sù)。或者,可(kě)將熒光素條置於塑(sù)料注射器中,並加入預定體積的無菌生理鹽水,以產生已知熒光素濃度的溶液,然後滴在角膜上。由眼科檢查人員使用帶有鈷藍濾光片的生物顯微(wēi)鏡(jìng)對角膜進行檢查,觀察是否有殘留的熒光。
04、眼部(bù)照相
眼部照(zhào)相可用來(lái)證明眼底等區域無變化,或記錄異常以(yǐ)及監測病變的進展。可在研究期間的不同時間點拍攝照片來進(jìn)行比(bǐ)較,以準確地確定異(yì)常是靜態的還是進行(háng)性的。由於照相增加了(le)額外(wài)的時間、成本和(hé)動物應激(jī),因此(cǐ)並非(fēi)所有研究均需進行。在觀察到病變時,或(huò)很可(kě)能引起眼部異常的研究中(例如眼內植入物,玻璃體內或視網(wǎng)膜下注射研究),可在研究方(fāng)案中將其作為一種記錄(lù)病變的選擇。
眼部(bù)照相可分(fèn)為眼外部(bù)和眼內部。眼外部的(de)拍攝可使用帶有(yǒu)微距(jù)透鏡的標準單鏡頭反光(SLR, Single Lens Reflex)數碼相(xiàng)機,或帶屈光(guāng)度設置調節以允許眼外部和眼前節成像的數字 Kowa Genesis-D 眼底照相機。眼後節的拍攝需要特(tè)定類型的眼底照相機(jī),數字(zì)化Kowa Genesis-D 照相機、RetCam、Phoenix Micron IV 和 Micron X 適用於大多數實驗動物的拍攝(圖4)。這些照相(xiàng)機可適用於間(jiān)接眼部照相、齧齒類動物眼底照相和熒光血管造影。眼底照相的優點是能夠永久保存記(jì)錄,以比較潛(qián)在的研究相關結果,如果有發現,則可(kě)由另一名眼(yǎn)科檢查再次進行獨立審閱(yuè)。
在拍攝照片時,所有照片都(dōu)應使用相同的放大倍率和(hé)照明設置。此外,所有動物均應按相(xiàng)同眼(yǎn)別(bié)順(shùn)序(左和右)進行拍攝,同時應保存動物標識和設備日誌等拍(pāi)攝記錄。上述(shù)標準也可作為標準(zhǔn)操作規程 (SOP, Standard Operating Procedures) 的一部分。
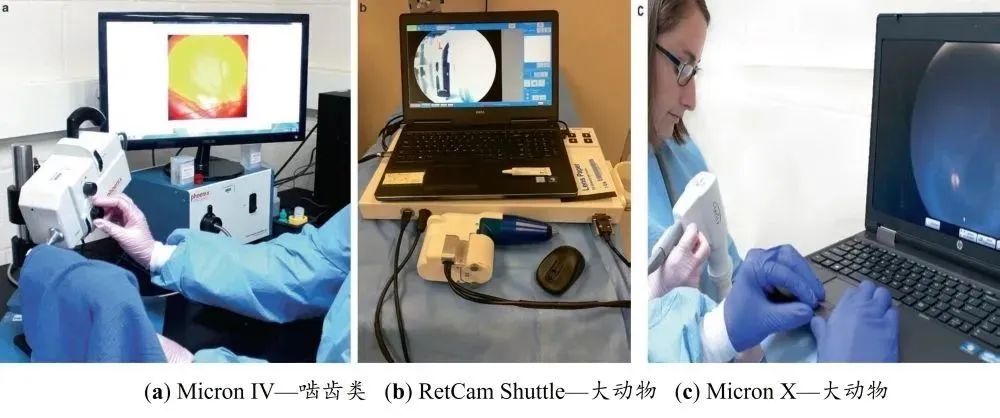
圖4 可用(yòng)於實驗動(dòng)物的眼(yǎn)底相機
05、熒光血管造影
熒光血管造影(yǐng)可用於評價眼內動脈和靜脈的血管完整性。雖然其最常用於檢查視網膜和脈絡膜的血管,但也可用於檢查虹膜血管。在(zài)毒理學研究中最常用於評價供(gòng)試品對於新生血管形成的影響。目前,它(tā)已被應(yīng)用於多種實驗動物(wù),最(zuì)常(cháng)選用的是10%熒(yíng)光素鈉,也有部分研究選擇吲哚菁綠。
熒光血管造影技術(shù)需要散瞳,並(bìng)進行鎮靜或麻醉。將光可激發(fā)的化合物熒光素靜脈注射,可獲得目標組織(脈絡膜視網膜和虹膜)的一係列定時圖像。與熒光素注射相關的並發症可能包(bāo)括滲漏後組織刺激、嘔吐和過敏反應(yīng)。必須在能夠拍攝多(duō)幅、快速排序圖像的眼底照相機上使用激發濾光片 (490 nm) 和(hé)屏障濾光片 (520-520 nm)。Kowa Genesis-Df、RetCam Shuttle、Phoenix Micron X 和 Heidelberg Spectralis cSLO 可用於熒(yíng)光血管造影,且是便攜式的(圖4)。在注射熒光素前,先拍攝對照的彩色圖像(xiàng),然(rán)後每 20s 拍攝一組,獲得連續圖像。由於熒光素填充脈絡膜視(shì)網膜(mó)血管,因此(cǐ)描述了血管流動的各個階段。它(tā)們包括動脈前期、動脈期、動靜脈期、靜脈期及後期。熒光血管造影觀察(chá)到的異常(cháng)可能(néng)包括血管異常(動脈(mò)瘤、新生血管形成)、熒光(guāng)受阻、熒光素滲漏(lòu)、低熒光和高熒光(guāng)。
06、視網膜電圖(tú)/視覺誘發電位
根據毒理學研究目(mù)的,以及可(kě)能受影響的視覺係統的特定方麵,有多種(zhǒng)電生(shēng)理學試驗可用於(yú)評價視網膜和(hé)視覺通路。視(shì)網膜電圖 (ERG, Electroretinography) 是測量(liàng)視(shì)網膜(mó)在受到光刺激時產生的電勢(shì)。標準 ERG 是一種(zhǒng)全視(shì)野刺激,可提(tí)供關於整個視網膜的信息,是視網膜色(sè)素上皮、光感受器和內層視(shì)網(wǎng)膜的群(qún)體反應。對於局(jú)部(bù)視網膜評價可選(xuǎn)用多焦視網(wǎng)膜電圖 (mfERG, multifocal electroretinogram)。對於黃斑區神經節(jiē)細胞的(de)評價可(kě)選用圖形倒(dǎo)轉視網膜電圖 (PERG, pattern reversal electroretinogram)。而為了評價從(cóng)視網膜到視覺皮層的整個視覺(jiào)通路,視(shì)覺誘發電(diàn)位 (VEP, visual evoked potential) 則是首選技術。在這些(xiē)試驗中,全視野 ERG最常用於臨床前毒(dú)理學試驗。ERG 提供了一種非侵入性的可重複評估視網膜功能的方法,它可結合間接檢眼鏡和組織病理學來對視網膜結構和功(gōng)能進行綜合評估。
ERG應(yīng)在散瞳後按標準流程進行,目前(qián)人和犬的ERG有許多可參考的國際指南,可作為試驗(yàn)設計的參考。在獲得全視野ERG過程中,如(rú)下條件建議保持一致:房間照明情況(kuàng)、暗適應、閃光強度、頻率以及使用的鎮靜或麻醉劑劑量。
07、光學相幹斷層掃描
光學相幹斷層掃描是一種高分辨率的無(wú)創成像技術,可提供眼部結構的實時橫(héng)斷麵圖像,最常用於視網膜和(hé)視神經,其軸向分辨率為 2-10 μm,也可用於眼前節的成像。與許多先進的成像技(jì)術(shù)一樣,它需要鎮靜或麻(má)醉、散瞳和專門的設備。當進(jìn)行(háng) OCT 成像時,可(kě)看到所有的(de)單個視網膜層,並測量其厚度,以便隨時間進行定(dìng)量和多次重複(fù)評價。其可測量視盤的杯麵積、盤麵積、杯直徑、盤直徑以及邊(biān)緣麵積。通過 OCT 對前節進行檢查則可了解角膜、前房、虹膜和虹(hóng)膜角膜角的結構信息,且其無需像超聲(shēng)生物顯微(wēi)鏡 (UBM, ultrasound biomicroscopy) 所需的那(nà)樣接觸角膜。它還提供了比 UBM更高的軸向分辨率。OCT 在實驗動物中已(yǐ)應用於(yú)多個種(zhǒng)屬,其在人類疾病動物模型和臨床前試驗中的應用也將越來越多。
隨著技術的進步,頻域 OCT (SD-OCT, spectral-domain OCT) 使用非機械技術,比傳統 OCT 或時(shí)域 OCT (TD-OCT, time-domain OCT) 明顯更快。SD-OCT 同時測量一個光譜中多個波(bō)長的(de)反射光,因此被稱為光譜域。SD-OCT 比 TD-OCT 快 100 倍,每秒可采集 70,000 + 次 A-scan,其掃描速度和次數的增(zēng)加可轉化為更高分辨率。
08、角膜內皮顯微鏡檢查
角膜(mó)內皮(pí)顯微(wēi)鏡可對角膜內皮細胞進行活體非侵入(rù)性的成像觀察,可采用(yòng)接觸或非(fēi)接觸方法進行。一旦可視化,可評價角膜內皮細胞的細(xì)胞形態,並可定量為每 mm 的細胞數量 。正常角膜內皮細胞排列規(guī)則,呈六角形。內皮顯微鏡可評價細胞的密度、多形性和變異情況。由(yóu)於細胞數量可因動物年齡和角膜區域的不同而變化(huà),因此須使用相同年齡的動物對這些變量進行標準化,並檢查軸向角膜。須對動物進行鎮靜或麻醉,以獲得準確(què)的圖(tú)像(xiàng),並可適用於簡化技術的自動化係統。FDA 已經設立(lì)了關於臨床試(shì)驗中角(jiǎo)膜內皮顯微鏡檢查的指南,這些指南可以作為臨床前研究設計的起(qǐ)點。除角膜內皮顯微鏡外,還可選用體(tǐ)內高分辨率共聚焦顯微鏡 (Heidelberg Retina Tomograph with Rostock Corneal Module) 進行角膜內(nèi)皮成像和分(fèn)析(圖5)。
圖5 Heidelberg Retina Tomograph (with Rostock Corneal Module)用於角膜內皮的成像和分析
小結
在本篇文章中,我(wǒ)們總結了在(zài)醫藥行業等(děng)研究場景中(zhōng)的非常規眼科檢查(chá)的適當方法和技術。這些技術將在眼部毒理(lǐ)學領域中越來越普遍,技術人員可在(zài)研究過程中根據試(shì)驗的設計和已發現的(de)眼科學變化等(děng)關鍵因素,來選用進一步的檢查辦法。
參考文獻
[1] Gilger B C, Cook C S, Brown M H. Standards for Ocular Toxicology and Inflammation [M]. 2018.


